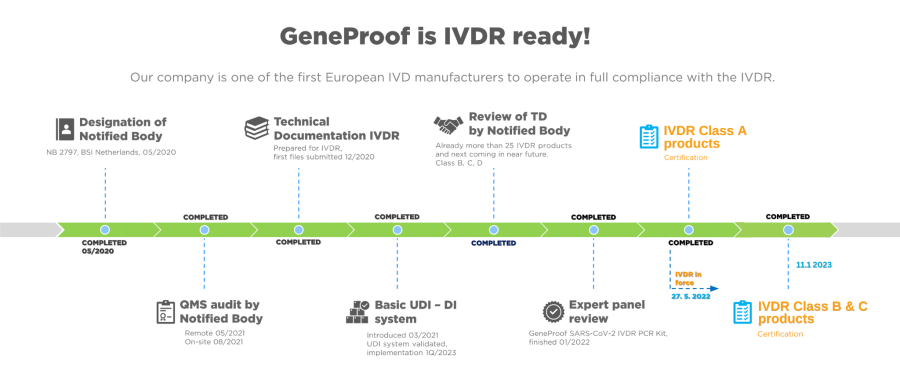
Činnost společnosti je k 27. 5. 2022 plně v souladu s Nařízením Evropského parlamentu a Rady (EU) 2017/746 v platném znění.
I nadále tak můžeme nabízet a prodávat celé naše portfolio více než 80 CE IVD produktů podle nových pravidel pro in vitro diagnostiku v EU.
Všechny produkty třídy A jsou nyní IVDR!
Stáhněte si nové ES Prohlášení o shodě a Návody k použití k vybraným IVDR produktům zde.
Všechny ostatní PCR kity (které byly klasifikovány jako ostatní in vitro diagnostické prostředky podle IVDD) jsou plně v souladu s NAŘÍZENÍM (EU) 2022/112 – (IVDR novela z 01/2022) a jsou plně dostupné.
I nadále úspěšně pokračujeme na cestě k IVDR certifikaci produktů třídy „B“, „C“ a „D“:
Na GeneProof se můžete spolehnout – dnes i v budoucnu!
Zajímá Vás ještě něco? Neváhejte se nám ozvat na marketing@geneproof.com.
+420 543 211 679
sales@geneproof.com
Poslat dotaz
+420 730 176 222
support@geneproof.com